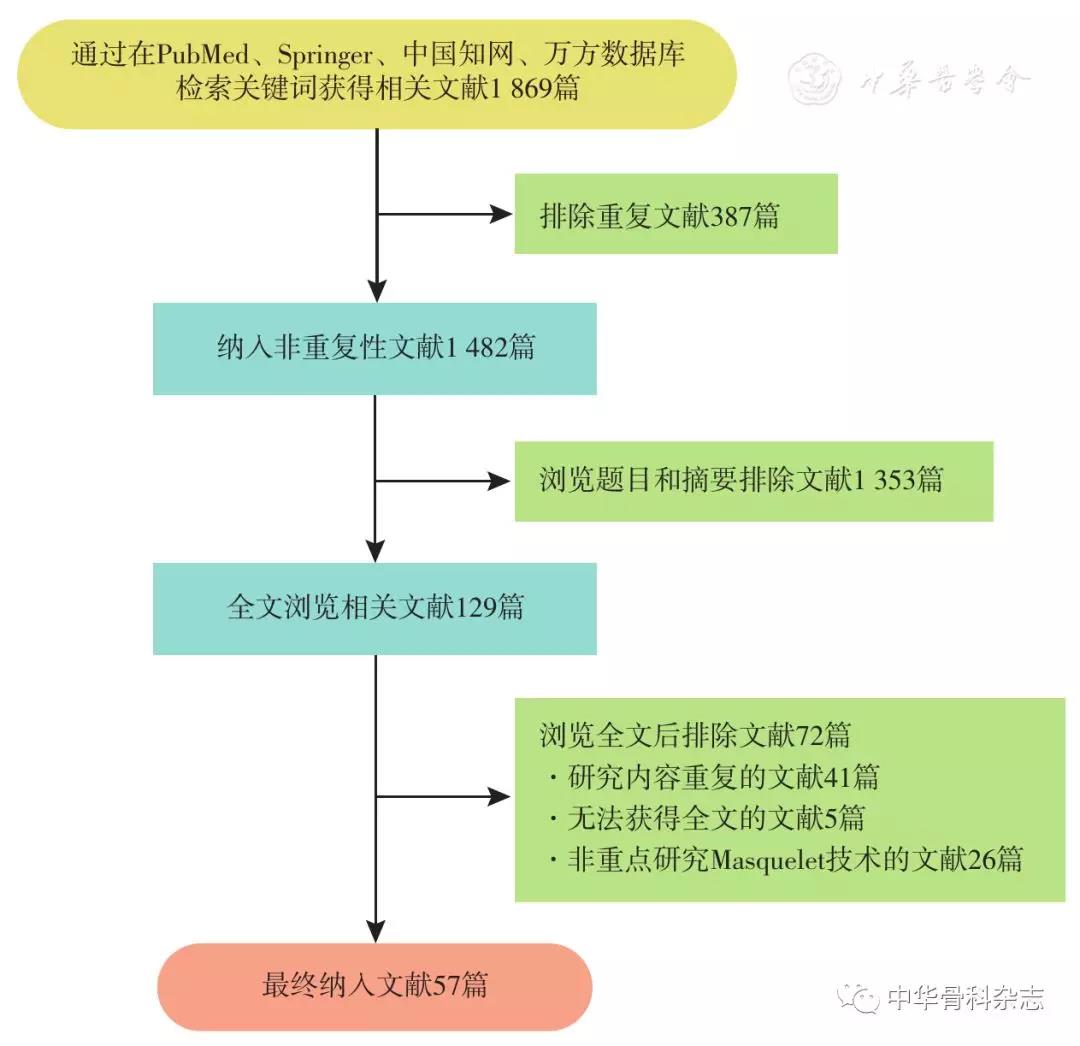
Masquelet技术治疗骨缺损的研究进展,看这篇!

文章来源:中华骨科杂志, 2018,38(3) : 186-192
作者:蔡成阔 舒衡生
一、骨诱导膜的分子生物学基础及生理作用
骨诱导膜是通过Masquelet技术在骨缺损部位诱导产生的膜结构,是成功修复大段骨缺损的早期关键组织。人们通过动物模型验证了其在骨愈合过程中的关键作用,对诱导膜的组织学和生物学特性有了进一步的认知。免疫组织化学分析结果显示:诱导膜是一种高度血管化的组织,厚度为1~2 mm,由Ⅰ型胶质细胞组成,成纤维细胞是其主要细胞类型;膜的内面由上皮样细胞和成纤维细胞、肌成纤维细胞和平行于膜表面的胶原纤维束组成[16,17,18]。对膜蛋白的分析显示,诱导膜中含有高浓度的血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子β1(transforming growth factor-β1,TGF-β1)和骨形态发生蛋白-2(bone morphogenetic protein 2,BMP-2)等多种生长因子,能促进骨的再生及修复。膜蛋白提取物还具有刺激骨髓细胞增殖以及间充质细胞膜分化的特性。膜内的成纤维细胞中高水平表达的核心结合因子α-1对成骨细胞发育具有关键作用[19]。此外,骨诱导膜可为骨的愈合提供闭合空间,避免软组织长入及移植骨的重吸收[16,17]。对诱导膜的特性进行研究是骨组织工程学的研究热点。
二、骨诱导膜技术
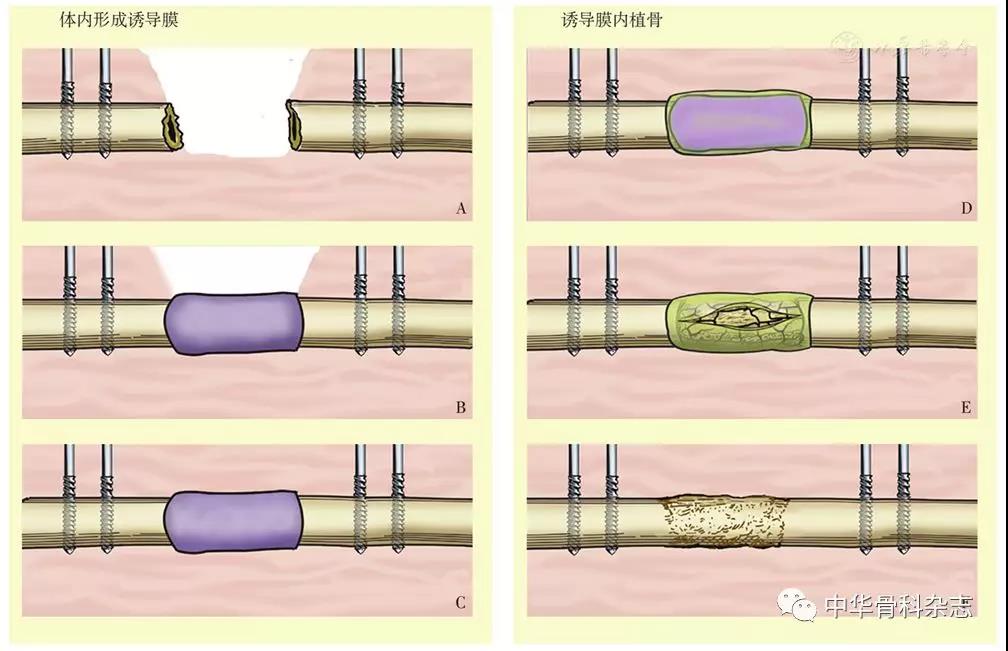
骨诱导膜技术主要包括体内形成诱导膜及诱导膜内植骨两个阶段(图2)。体内形成诱导膜:首先进行骨缺损部位的彻底清创,清除感染及坏死组织;根据骨折具体情况选用合适的固定方式对骨折进行稳定的固定,为软组织修复提供稳定的力学环境;应用聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥填充骨缺损部位;感染性骨缺损则根据细菌培养药敏结果或经验使用含敏感抗生素的骨水泥。诱导膜内植骨:第一次术后6~8周纵行切开诱导膜结构,小心去除骨水泥;使用钻头或骨锉去除两侧骨端及髓腔的硬化骨,促进植骨融合[20],于骨膜内填充自体松质骨,缝合诱导膜,防止移植骨的重新收。
图2 Masquelet技术示意图 A 骨缺损部位彻底清创,对骨折进行稳定固定 B 用骨水泥填充骨缺损部位 C 软组织充分包裹骨水泥 D 6~8周后骨水泥周围诱导膜形成 E 纵行切开诱导膜,移除骨水泥,填充自体松质骨(或皮质骨、同种异体骨与人工骨),之后缝合诱导膜 F 移植骨与周围骨质融合
(一)体内形成诱导膜
1.固定方式的选择
可选用外固定支架(单臂或者环形)、钢板以及髓内钉等多种固定方式对长管状骨进行固定。外固定支架可以提供足够的稳定性,同时减少金属植入物带来的额外的感染风险[20];髓内固定可以实现早期负重,同时维持更好的力线,减少二期植骨量[21]。殷渠东等[22]认为对四肢非感染性骨缺损应首选髓内固定,邻近关节等部位的骨缺损可选用外固定支架,稳定性较好及跖骨等较小部位的骨缺损也可选用石膏托固定。对感染性骨缺损,建议一期采用外固定支架而二期改为内固定更安全。
2.骨水泥填充
Masquelet和Obert[23]指出对骨缺损区进行骨水泥塑形时,骨水泥应包裹住两断端,扩大骨水泥与健康骨的接触面积,同时保证足够的软组织覆盖,无张力关闭伤口。可以应用转移皮瓣或游离皮瓣移植术及真空封闭引流(vacuum sealing drainage,VSD)负压吸引技术解决软组织覆盖不足[20]。Taylor等[24]认为应在软组织条件允许的前提下尽量植入比实际缺损多的骨水泥,从而为第二阶段手术提供足够的骨移植空间;对骨水泥进行塑形使其与断端和固定物(如髓内钉)充分接触;最好对骨水泥进行体外塑形或将骨水泥植入体内后用生理盐水冲洗,以减少骨水泥塑形过程中的热损伤。
Pauchot等[25]在植入骨水泥过程中应用注射器针筒辅助塑形,可减少骨水泥塑形过程中热效应对周围组织的损伤。张辉等[26]报告采用空心多孔抗生素骨水泥进行体外塑形和体内灌洗,可避免植入实心骨水泥后的二期取出困难及抗生素释放率低等问题。殷渠东等[27]对骨水泥进行体外塑形,制作成空心多块骨水泥填塞物,使二期去除填塞物变得简便,同时可配合髓腔冲洗,获得较好的骨愈合效果和控制感染效果。
3.填充物的选择及改进
PMMA骨水泥具有良好的生物相容性和生物惰性,是一种理想的填充材料[28]。魏富达等[29]建立了不同骨填充物对新西兰兔桡骨骨缺损诱导膜形成的影响的模型,结果显示PMMA骨水泥填充物形成的诱导膜具有较强的促血管化和成骨活性。但PMMA存在固化过程中放热反应导致骨坏死和局部软组织损伤及未反应单体带来的全身或局部过敏反应等缺点[30]。Bosemark等[31]应用磷酸三钙羟基磷灰石(tricalcium phosphate hydroxyapatite,TCP)替代PMMA进行家兔股骨缺损的治疗,愈合率达90%。Nau等[32]的动物实验首次证实了在骨水泥中添加不同的添加剂(如抗生素或碳酸钙)会改变诱导膜的厚度及弹性纤维含量,庆大霉素等抗生素的细胞毒性作用还会对诱导膜产生影响。相关的研究还需进一步深入,以便充分利用各种添加剂对诱导膜的有利影响缩短两次手术的间隔。
由于PMMA骨水泥需要二次手术取出,近年越来越多的学者致力于探究生物可降解材料的应用,如明胶/β-磷酸三钙(β-tricalcium phosphate,β-TCP)复合多孔材料,可降解硫酸钙(degradable calcium sulfate)、聚乳酸(polylactic acid,PLA)、聚乳酸-羟基乙酸(polylactic-co-glycolic acid,PLGA)以替代PMMA[33,34,35]。文献表明,可降解材料具有与PMMA相似的骨再生、骨优导、骨传导特性,这可为骨诱导膜技术的改进提供新思路。
(二)诱导膜内植骨
1.二期手术时机
通常选在第一次手术后6~8周,此阶段诱导膜已形成[36],分泌的成骨因子达到高峰[22,37],可保证骨缺损周围组织及血运的修复重建[25]、游离或带蒂肌瓣上皮化[38]及原发感染的清除[39]。而Masquelet等[15]建议两阶段手术间隔4~8周。二期手术前应检查白细胞计数及分类,红细胞沉降率、C反应蛋白及骨组织活检以明确感染控制情况。
2.移植骨的选择
移植骨最好选用自体松质骨,可以取自体髂骨(包括髂前上棘、髂后上棘)或应用钻孔-灌洗-抽吸系统(reamer-irrigator-aspirator,RIA)从骨髓腔中获取。Dawson等[40]认为,应用RIA系统可以获得相对更多的骨量,减少取骨时间,改善供区疼痛。但Karger等[41]认为,单独使用RIA系统获取自体骨易导致移植骨中心血管化不良从而产生骨的不规则愈合,进而影响后期成骨。另外,Viateau等[16]及Hesse等[42]的研究均表明,植入组织工程骨材料,后期可获得良好的成骨效果。
当骨缺损量较大、自体松质骨量不足时,可用皮质骨、同种异体骨与人工骨替代,替代骨量与自体松质骨骨量的比例不应超过1∶3,否则会影响后期成骨效果[42]。此外,孙明学等[43]对海绵状及灰泥状脱钙骨基质(demineralized bone matrix,DBM)的诱导成骨及骨传导作用进行了实验性观察,结果证实DBM(尤其是海绵状DBM)的成骨能力较强,且新生骨的力学强度及矿化程度接近正常骨质,但未见有关技术与诱导膜技术联合应用治疗严重骨缺损的临床报道。
Masquelet和Obert[23]报告在移植骨中加入重组BMP-7的促进骨愈合效果并不理想。Niikura等[44]报告1例应用低强度脉冲超声波辅助骨诱导膜技术治疗骨缺损,诱导膜内植骨后4周骨折愈合良好,患者可无痛行走,提示低强度脉冲超声波可作为诱导膜技术的辅助治疗。
三、骨诱导膜技术的临床应用
Masquelet等[15]于2000年最早报告应用骨诱导膜技术治疗35例缺损范围为4~25 cm的长骨骨干缺损,影像学结果提示二期手术后平均4个月骨缺损部位完全愈合。近年有大量文献报道涉及应用诱导膜技术修复不同部位的多种类型的骨缺损,均取得满意疗效。
(一)创伤后骨缺损
Moris等[45]应用诱导膜技术治疗手及腕部骨缺损16例、骨不连2例,16例患者(90%)在骨移植术后平均4个月(2~12个月)达到影像学愈合,功能得到恢复。Yeganeh等[46]报告2012至2015年应用诱导膜技术治疗21例枪弹伤后股骨、胫骨、跖骨骨缺损患者,17例(90%)在平均7.35个月(4~12个月)获得临床和影像学愈合,2例后期进行了Ilizarov手术或截肢。Taylor等[47]报告应用诱导膜技术治疗69例创伤后骨缺损患者,其中胫骨35例、股骨16例、桡骨6例、肱骨6例、跟骨2例、跖骨2例、掌骨1例、尺骨1例,82.6%的患者在植骨后平均26.6周获得愈合。许多临床研究表明,Masquelet技术治疗四肢创伤后骨缺损有良好的效果。
(二)骨髓炎相关骨缺损
张一等[48]回顾性分析了采用骨膜诱导技术结合抗生素硫酸钙颗粒治疗的感染性骨缺损9例,9例患者于平均14周(10~24周)愈合,随访6~15个月无感染复发。Wang等[49]评估了32例创伤后骨髓炎患者应用骨诱导膜技术的治疗效果,其中26例(81%)在6个月内达到影像学愈合,29例(90%)在10个月内达到临床愈合,其中6例患者因为再发感染进行了二次清创手术。Yu等[50]报告应用诱导膜技术治疗13例慢性股骨骨髓炎致大段骨缺损的病例,平均缺损9.8 cm(5~16 cm)。其中12例在平均20.3周(18~30周)获得影像学愈合,完全负重时间为第二次手术后5.8个月(5~8.5个月),末次随访时膝关节活动度平均122°(100°~135°);另1例在术后9个月内再发感染,再次进行骨诱导膜手术治愈,随访9个月未见感染再发。上述文献报道证实应用Masquelet技术治疗骨髓炎术后大段骨缺损效果满意。
(三)肿瘤相关骨缺损
Gouron等[51]回顾性分析了7例(恶性4例、良性3例,股骨4例、肱骨2例、尺骨1例)应用骨诱导膜技术治疗的骨肿瘤切除后骨缺损患儿。良、恶性骨肿瘤术后平均愈合时间分别为8、8.3个月,其中2例出现移植骨与远端骨不连(后期分别在术后8、11个月进行自体骨移植治愈)、2例在化疗过程中出现伤口裂开(通过VSD负压吸引治愈)、1例出现移植骨重吸收,无感染再发病例。Chotel等[52]报告采用骨诱导膜技术治疗8例骨肿瘤(骨肉瘤4例、尤文肉瘤3例、低分化肉瘤1例)切除后骨缺损,其中7例同时接受术前及术后化疗。下肢完全负重时间平均为术后第116天(第90至150天),平均愈合时间4.8个月;其中1例出现骨折不愈合,1例出现重吸收需要二期植骨。许多文献表明,与带血管蒂骨移植等其他方法相比,本技术治疗骨肿瘤切除术后骨缺损可以实现早期负重,缩短骨愈合时间,降低感染及供区并发症发生率,是一种简便、快捷、安全的手术技术。
(四)先天性胫骨假关节
Gouron等[51]应用骨诱导膜技术治疗4例先天性胫骨假关节病例,平均愈合时间为术后7.8个月,其中1例出现移植骨与近端骨端不愈合,通过更换外固定支架治愈。梅海波等[53]报告1例多次手术后的难治性先天胫骨假关节病例,随访2年2个月,胫骨17 cm骨缺损段完全成骨,膝关节活动度正常,屈曲畸形完全矫正。虽然文献报道中应用Masquelet技术治疗先天性胫骨假关节可取得较好的疗效,但由于相关文献较少,临床指导意义有限。
四、骨诱导膜技术的缺点及并发症
尽管诱导膜技术治疗大段骨缺损是一种简单、可靠、效果良好的方法,但也存在一些缺点及并发症,临床应用中要严格把握手术适应证及规范操作。
(一)再发感染
通常由不彻底的清创导致[54]。Wang等[49]应用骨诱导膜技术治疗创伤后骨髓炎32例,其中6例因清创不彻底出现再发感染,需要二次清创。对于感染病例的第一步清创范围目前尚无统一标准,通常可以通过术前CT、MRI、核素骨扫描等影像学检查及术中所见来确定清创范围[49]。
(二)移植骨吸收
有学者报告采用Masquelet技术治疗骨肿瘤切除后骨缺损术后出现二期移植骨重吸收[51,55],其原因可能与骨缺损范围过大、两次手术间隔过长、植骨后诱导膜闭合不全、骨缺损两端固定不稳定、移植骨中异体骨比例过高等有关。
(三)骨不连及假关节形成
应用诱导膜技术治疗骨缺损术后发生骨不连或形成假关节通常是由不当的手术操作导致[51,52,56,57],包括:①一期骨缺损端清理不充分或髓腔不通;②骨缺损范围内骨端骨水泥包裹不足,导致二期诱导膜内植骨不能充分连接骨缺损端;③植骨量不足,移植骨中异体骨比例过高;④骨缺损两端固定不稳定。
综上所述,骨诱导膜技术适应证广泛,手术操作相对简便,不需要复杂的显微外科技术,可缩短大段骨缺损的治疗周期,为解决较为棘手的骨缺损问题提供了一个比较简单、安全和更具成本效益比的解决方案,目前广泛应用于创伤后骨缺损、感染性骨缺损、肿瘤切除后骨缺损、先天性胫骨假关节等骨科难题,也可为颌面外科解决骨缺损问题提供了新的治疗思路。但该技术尚有许多可改进之处,例如如何在一期手术中确定可靠的清创范围?如何更合理地选择固定方式?新型骨水泥及骨水泥添加剂能否替代传统PMMA骨水泥获得更好的疗效?如何获得足够的二期植骨材料以填充大段骨缺损?如何减少术后并发症?这些问题仍需进一步探索和研究。
参考文献(略)
本文来源:中华骨科杂志
本文作者:蔡成阔 舒衡生
文章推荐